Los electrones de valencia, constituyen una fuente esencial en la interacción de varios elementos para concretar una composición química. En el estudio, es necesario utilizar la tabla periódica, refleja la cantidad de electrones orbitando en la capa externa. A partir de esa información, comprender cómo el sodio se enlaza con el cloro mediante esos electrones será simple.
Contenido
¿Cómo encontrar los electrones de valencia?
Saber dónde se encuentran los electrones de valencia, es ubicar en cualquier átomo su última capa, identificada “capa de valencia”. Estos electrones son partículas influyentes de la electricidad presente en los elementos, además, son responsables de los enlaces químicos. Razón por la cual, uno o dos átomos pueden interactuar y proceder a realizar una unión, creando compuestos químicos.
La valencia es un número real de electrones y enlaces a producirse. Sin embargo, esas cantidades pueden llegar hacer insuficientes. Por tal motivo, los átomos suelen ceder u obtener partículas para adquirir en un enlace, una capa completa. Los electrones orbitando en esa estructura externa, tienen el alcance de interactuar con otros en esa misma capa. Con respecto a los del interior, no sufren con mucha intensidad, puesto que están alejados de la superficie.
Cuando los átomos encuentran una estabilidad manteniendo una fuerza considerable, se debe descifrar qué tipo de enlace se produjo. Existen 3 relevantes en una composición; iónico, covalente y metálico. Cada uno con una función diferente, expuesta a continuación:
- Enlace iónico: los electrones se ganan y pierden entre 2 o varios átomos.
- Covalente: los electrones se comparten.
- Enlace metálico: basado en el traslape orbital.
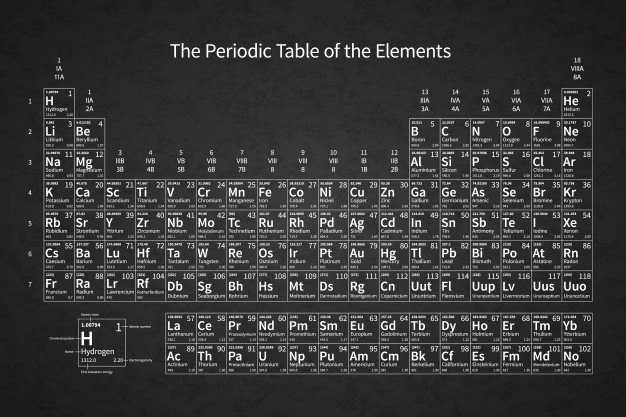
La tabla periódica, un instrumento esencial
Los expertos en el área elaborando sustancias químicas procuran distinguir a cada átomo y cuántos enlaces pueden formular. Aplicando la información de la tabla periódica y siguiendo ciertas pautas, los electrones de valencia son fáciles de contemplar:
En la conformación de la tabla periódica, se observan columnas verticales con un número, el cual hace referencia a los electrones de valencia. En el caso de no observar tal cifra, es válida una asignación que vaya del 1 culminando en el 18.
Por otro lado, en los elementos de grupo no metales, un seguimiento como el anterior no aplica. Ese número indicado es relacionado a la posibilidad de presentar electrones y la clasificación varia de la siguiente forma:
- El grupo 3: 3 partículas
- Grupo 4: de 2 hasta 4 partículas
- El grupo 5: de 2 hasta 5
- Grupo6: de 2 hasta 6
- Grupo7: de 2 hasta 7
- El grupo8: de 2 hasta 3
- El grupo 9: “ “
- Grupo 10: “ “
- El grupo 11: de 1 hasta 7
- Grupo 12: solo 2
Los electrones de valencia y el modelo de Shell
La teoría de repulsión Shell conocida en inglés como “valence Shell electrón par repulsión theory“, es un estudio figurativo. Así es, cada molécula constituye una geometría particular y este modelo aporta una idea. De acuerdo a los nombres de los científicos responsables de este avance químico, se nombra en algunas ocasiones como “Gillespie-Nyholm”.
A pesar de los conocimientos, Gillespie considera la teoría de exclusión relevante en comparación al tema de repulsión por electroestática. Concurriendo a la composición de metano (CH4), con una geometría en forma de tetraedro, se amplía esa afirmación. Debido a las repulsiones entre los enlaces de hidrógeno, estas se establecen alrededor del carbono originando un compuesto tetraedro.
Aunque, la identificación del modelo molecular es también presenciada por la estructura de Lewis. Empleando tal estructura en BeF2, el flúor mantiene a su alrededor varios pares con electrones de valencia. Los átomos de ese elemento con una distancia extrema, se unen a los del Berilio con la excepción de uno. Ahora, añadiendo un átomo más y convirtiendo el compuesto en BeF3, cambia su geometría de lineal a un trigonal.
Oxidación y valencia, algo que no se debe confundir
El significado de oxidación es común que se interprete erróneamente, si se compara con la valencia. Por eso, se establecen una serie de diferencias que permiten evitar una mala definición, estas son:
Valencia
- Es un valor sin signo. Representando por la cantidad de electrones orbitando en la capa más alejada del núcleo.
- El número de valencia indica la relevancia de otorgar o tomar electrones. En ese sentido, ocurre por parte de un elemento determinado. Completando correctamente esas partículas, la última capa enfatiza una energía adecuada, además, se conoce los enlaces posibles a ocurrir.
- Los elementos reciben un nombre en correspondencia a la cantidad de electrones. Así pues, estas pueden ser; monovalentes, divalentes, trivalentes… En el oro con valencias 1 y 3, ya son composiciones nombradas como “mono-trivalente”
Oxidación
- Es un valor parecido a la valencia. Indicando la capacidad de un átomo para formular enlaces. La diferencia se relaciona con ese número y el signo. Estos elementos pueden actuar diferente en una composición.
- La electronegatividad de los átomos en ocasiones suele ser alta. Característica propia de un elemento no metal.
- El estado de oxidación, también corresponde a una carga establecida. Ocurre luego de aislar un elemento químico con una mayor electronegatividad.
Una guía en velas
En efecto, ejecutar la guía llamada “velas”, se conoce la configuración de cada elemento, es decir, los electrones de valencia. Un sistema basado en la composición de las capas, un ejemplo es la constitución del sodio (1s2 2s2 2p6 3s1). En ese patrón en forma de velas, se observa el número de electrones en cada orbital. Específicamente 3s1, la capa con posibilidad a interactuar con otros elementos, se encuentra formulada por un solo electrón.
Enseguida, se mencionan otros casos:
- Fosforo (P): 1s2 2s2 2p6 3s2 3p3, aquí la capa 3 se divide en 2, identificadas con s y p. Como resultado, se deduce la existencia de 5 electrones en la última capa.
- Bromo (Br): 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5, ese elemento contiene 7, como se puede observar de los orbitales 4.
- Hierro (Fe): 1s2 2s2 2p6 3s2 3p6 4s2 3d6, solo cuenta con 2 electrones, ubicados en el 4.
Los electrones de valencia y la importancia en las reacciones químicas
En la formulación de moléculas, es importante y necesaria a valencia de cada elemento por individual. Además, conociendo ese valor se puede descifrar el nivel de enlaces a producir en la integración con varios átomos. Sin la presencia de tales partículas, no ocurriría una reacción química entre elementos iguales o diferentes.

