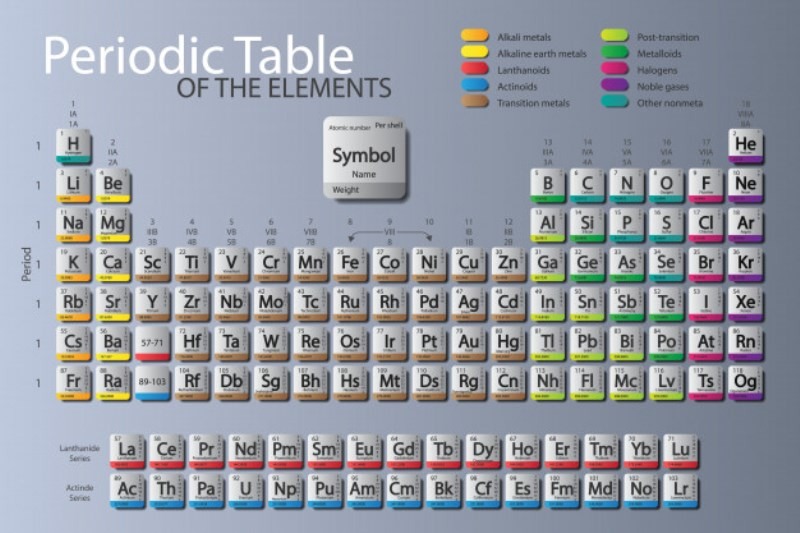
La tabla periódica de los elementos químicos, es una estructura elaborada para organizar todos los componentes. Colocados de manera creciente, agrupados según sus propiedades y características en bloques, períodos y grupos. Este esquema consta de 7 filas horizontales llamadas períodos. De igual forma, de 18 columnas verticales denominadas grupos.
Estos grupos o columnas verticales anteriormente se clasificaron usando números romanos junto con las letras A o B. En la actualidad, se enumeran los grupos del 1 al 18 consecutivamente. Además, también la tabla periódica de los elementos se encuentra dividida en 4 bloques con propiedades físicas y químicas semejantes.
Contenido
Antecedentes históricos de la tabla periódica de los elementos químicos
A principios del siglo XIX, los científicos trataron de encontrar formas de clasificar los elementos químicos, con la finalidad de simplificar su estudio. En tal sentido, uno de los primeros intentos, fue el del químico alemán Johann Dobereiner. Sobre todo, porque con grupos de tres elementos de propiedades similares formó lo que se denominó una tríada.

Posteriormente, en 1863 el químico inglés John Newlands, inventó otra clasificación. De tal manera que, ordenó los elementos según sus masas atómicas crecientes. Señalando que en cada ocho elementos, se repetían las propiedades. Por lo tanto, los colocó en siete grupos de siete elementos por grupo. Esta estructura se denominó Ley de las Octavas.
Seis años después, el químico ruso Dimitri Mendeleev, sugirió una clasificación semejante. Como resultado, planteó que las propiedades de los elementos eran función de sus masas atómicas.Sin embargo, Mendeleev observó que después de los períodos de longitud variable se encontraban propiedades similares.
En 1871, Mendeleev desarrolló un sistema de clasificación. Por consiguiente, determinó que manteniendo un orden ascendente de las masas atómicas de los elementos. Estos se distribuían en ocho grupos. De tal manera, que aquellos de propiedades similares quedaban ubicados en un mismo grupo.
Mendeleev consideró las propiedades de los elementos como función periódica de sus masas atómicas. Por lo tanto, a este enunciado se le denominó Ley Periódica.
Estudios que marcaron la diferencia
En 1914 el científico inglés Henry Moseley, estudiando los rayos X emitidos por los elementos, observó que el espectro formado se iba alejando hacia la derecha. Asimismo, que la desviación aumentaba al aumentar la masa atómica de los elementos. Con ello, concluyó que a cada elemento se le podía asignar un número entero. Como resultado, era proporcional a la raíz cuadrada de la frecuencia de los rayos X resultantes. Por lo tanto, observó que era función lineal de la posición del elemento en la tabla periódica.
De esta manera, demostró que para una mejor clasificación de los elementos, estos se deberían ordenar con base en sus números atómicos. Esto constituyó el factor fundamental para el enunciado moderno de la Ley Periódica: “las propiedades de los elementos, son función periódica de su número atómico”.
La tabla periódica de los elementos químicos en la actualidad
Si se examina la tabla periódica se observa que consta de filas horizontales, llamadas períodos. Además de columnas verticales, que se denominan grupos. En ese sentido, cada grupo tiene un número asignado que aparece escrito encima de la columna vertical correspondiente.
De los siete períodos existentes, todos, excepto el primero, comienzan con un metal alcalino (litio, sodio, potasio, rubidio, cesio, francio). Por otro lado, todos, excepto el séptimo y último, que está incompleto, terminan con un gas noble (helio, neón, argón, criptón, xenón, radón).
La longitud de los sucesivos períodos varía de 2 (exceptuando el primer período, que solo comprende el hidrógeno y el helio) a 32 elementos.
- El segundo y el tercer período contienen 8 elementos.
- Mientras que el cuarto y el quinto contienen 18. Los cuales, para referirlos a los 8 grupos de la tabla, se dividen en un primer sub período de 7 elementos. Además de un grupo de 3 elementos muy parecidos que forman el grupo VIII.
- Asimismo, un segundo sub período de otros 7 elementos, y el gas noble final.
- El sexto período comprende 32 elementos. Pero 14 de ellos, de propiedades físicas y químicas prácticamente iguales. No tienen cabida en la tabla y se sitúan fuera de ella. Estos elementos se denominan lantánidos.
- Seguidamente, el séptimo período comprende elementos que han sido producidos artificialmente (todos los que le siguen al uranio).
Clasificación de los elementos químicos
Es difícil establecer una clasificación de los elementos químicos. Sobre todo, porque cada uno de ellos posee propiedades particulares. Tanto físicas como químicas. Pero para facilitar su estudio, debemos tener presente la siguiente división. La finalidad es lograr obtener un indicador de cuáles pueden ser las propiedades y características de ese elemento.
La subdivisión más útil de los elementos, es en las categorías: metales, metaloides y no metales.
Metales
De todos los elementos que se conocen, el 80% son metales. Con excepción del mercurio (Hg) que lo encontramos en forma líquida. Todos los metales se presentan normalmente en estado sólido.
La mayoría de los metales, pertenecen a las series de transición y transición interna (lantánidos y actínidos). Los sólidos naturales, que contienen los metales, se denominan minerales.
Metaloides
Poseen propiedades intermedias, entre los metales y los no metales. Manifiestan las propiedades características de ambos grupos. En particular, su conductividad eléctrica es intermedia entre la de los metales y los no metales.
Químicamente, su comportamiento no metálico es mayor que el metálico.
No metales
De todos los elementos químicos conocidos, solo el 20% puede considerarse como no metales. Muchos de ellos son gases a temperatura ambiente. De hecho, los que son sólidos tienden a ser quebradizos, no son maleables ni dúctiles.
Características de la tabla periódica de los elementos químicos
Metales
- Alta conductividad eléctrica.
- Conductividad térmica.
- Aspecto: brillo metálico.
- Casi todos son sólidos (excepto el mercurio, cesio y galio).
- Maleables.
- Dúctiles.
- Electropositivos.
- Forman cationes y pierden electrones.
- Baja energía de ionización.
No metales
- Baja conductividad eléctrica.
- Buen aislante del calor.
- Aspecto no metálico.
- Sólidos, líquidos o gaseosos.
- Quebradizos.
- No dúctiles.
- Electronegativos.
- Forman aniones y ganan electrones.
- Elevada energía de ionización.
Importancia de la tabla periódica de los elementos químicos
La importancia de la tabla periódica se enfoca en establecer para cada elemento lo siguiente:
- El número atómico.
- La masa atómica.
- El símbolo.
- La actividad química.
- Las características del elemento asignadas por el grupo y período.
- El estado (sólido, líquido, gaseoso) y tipo del elemento (metálico o no metálico).
La tabla periódica de los elementos químicos es un instrumento necesario en el área de la química. Sobre todo, porque permite determinar las propiedades y las similitudes de los elementos.