El estudio de un átomo es un tema basado en la estructura de cada componente, que forma parte de él. Por eso, en estas investigaciones se menciona qué es la configuración electrónica de los elementos y qué relación tienen. Diversos aspectos como; los electrones, niveles, subniveles, son explorados, a fines de comprender esta naturaleza.
Contenido
Afectación de la energía: qué es la configuración electrónica de los elementos
En la estructura de un átomo, se observan diversos elementos involucrados en el sistema. En química, para saber qué es la configuración electrónica de los elementos se debe entender la relación en ese orden específico de cada uno. Exponiendo el significado exacto; configurar es sinónimo de ordenar, y electrónica guarda relación con los electrones. Ahora bien, agrupando esos términos, se define como la ubicación de esas partículas en los orbitales de un átomo correspondiente.
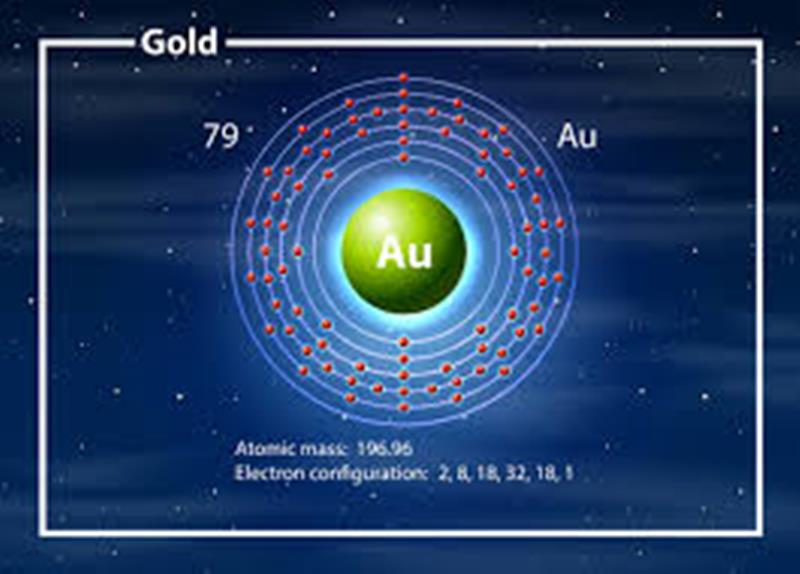
Cuando un átomo contiene la misma cantidad de electrones y protones, se encuentra en una fase neutral. Es necesario señalar que los electrones se posicionan en las sub capas, rodeando el núcleo y promoviendo un nivel de energía. Esos niveles de energía se dividen en 7, con 4 subniveles (s, p, d y f). Agrupados así:
- 1.er Nivel: s
- 2.º Nivel: s y p
- Nivel 3: s, p y d
- Nivel 4 hasta el 7: s, p, d y f
Definir qué es la configuración electrónica de los elementos, es hablar de la energía en un átomo. Así pues, aplicar energía a los electrones hace una incrementación de la misma. Luego, en correspondencia a la categoría, comienzan a situarse en la potencia mínima hasta culminar en la máxima.
Dos métodos con un mismo propósito
Comprender la regla planteada por Madelung, es estudiar primeramente el de Moeller, también conocido; método de la lluvia. Ambos, con el objetivo de interpretar qué es la configuración electrónica de los elementos. El primero es un análisis de los números en cada orbital, es decir, con valores resultantes de la ecuación n+l. Las iniciales distinguidas en esa ecuación, significan número cuántico (n) y angular orbital (l).
Ampliando esa información, se toma como ejemplo “3d”, este hace referencia a un orbital, aquí n: 3 y l: 2. Estableciéndose una ecuación donde n+l: 3+2, arrojando un resultado con un valor de 5. Ahora con un 4s, la diferencia es manifestada con un n: 4 y l: 0, una adición de 4+0: 4. En conclusión, la realización de esta operación evidencia que el segundo orbital es menor en comparación al primero. Por lo tanto, tienden a ser llenados por los electrones rápidamente.
La configuración en el método de Madelung, requiere la investigación del número atómico (Z). A partir de ese conocimiento, enfatizado en la cantidad de electrones, se continúa con los gráficos en diagonales. Iniciando a completar la falta de electrones desde el orbital 1s, seguido por 2s, 2p… Culminando con la última partícula.
Aspectos a considerar
En el estudio de qué es la configuración electrónica de los elementos es posible una clasificación de términos numéricos complejos. Por tal motivo, se explican a modo de concepto, algunos de ellos:
- Cuántico: en la ecuación expresada por Schödinger, considera tres de este tipo. Estos representan un orbital, el cual indica la separación existente con el núcleo y la gran posibilidad de conseguir un electrón.
- Principal (n): expresa el grado de energía, con valores tales como: 1, 2, 3, 4, 5… Además, determina la magnitud de un electrón para lograr posicionarse en el núcleo.
- Secundario: representados por una letra (l), son los llamados subniveles donde se puede concentrar la energía y el modelo orbital. Por eso, se dice que dependen de los números cuánticos principales y la formulación viene dada por (n-1).
- Cuántico magnético (ml): un número de esta clase determina la cantidad de orbitales en los subniveles con valores de -1 a +1
- Cuántico espín (ms): la dirección de los electrones, está relacionada con el movimiento de las agujas de reloj. En sentido contrario, también pueden viajar y en ese estudio se emplean valores de espín como, +1/2 o negativos -1/2.
El átomo y su configuración
De acuerdo a lo señalado anteriormente, la estructura ejercida por los electrones es definida principalmente por la energía. Sin embargo, saber cómo los electrones se ubican en las 3 exteriores capas es algo que se desconoce. Debido a una limitación de elementos influyentes, para poder utilizar medidas fisicoquímicas y así, conocer el orden.
Por lo general, los elementos mantienen un orden específico, mientras que otros no tanto. En estos último, las configuraciones no suelen contener una característica de estabilidad por contener orbitales llenos o vacíos. Conforme a la configuración, es imprescindible conocer la cantidad de capas (n), una información expresada en cualquier tabla periódica. Además de otros factores como; la clase de orbital y el superíndice.
Escogiendo un elemento de la tabla, en este caso, el carbono (C) se observa una presencia de 6 electrones. Reflejando una configuración electrónica de 1s2 2s2 2p4. Con una similitud a la del gas noble, es posible abreviar de la siguiente manera: [HE] 2s2 2p4.
El Helio (HE), representado 1s2 está integrado con un número cuántico (1) y, un subnivel con 2 electrones. El cloro (CL), 1s2 2s2 2s6 3s2 3p5 en la capa exterior se compone de 5 electrones.
Distribución de las capas
Los electrones son la fuente de cada capa presente en un átomo, conocidas como capas electrónicas. Estas pueden ser pocas o varias rodeando el núcleo, lo verídico es que con muchas, la distancia es prolongada. Por lo tanto, esos electrones a un extremo lejano del centro de un átomo, crea una unión débil.
Según recomendaciones pedagógicas, es factible representar un átomo de forma visual. Por ejemplo, comenzando con el núcleo, este puede ser dibujado con un círculo incluyendo la cantidad de protones. Seguidamente, se plasman las capas en especie de arcos con el mismo diámetro del núcleo, pero con los tamaños respectivos. En esos arcos es relevante indicar los electrones, lugar donde trabajan los niveles de energía.
Es importante conocer qué es la configuración electrónica de los elementos
Llevar a cabo una configuración electrónica es un conocimiento de la serie de electrones a distribuir en los niveles. Todo dependerá de la energía, se debe tener presente que para iniciar es fundamental ubicar los más bajos. Ubicados los electrones en la posición correspondiente, el átomo contendrá un orden correcto.