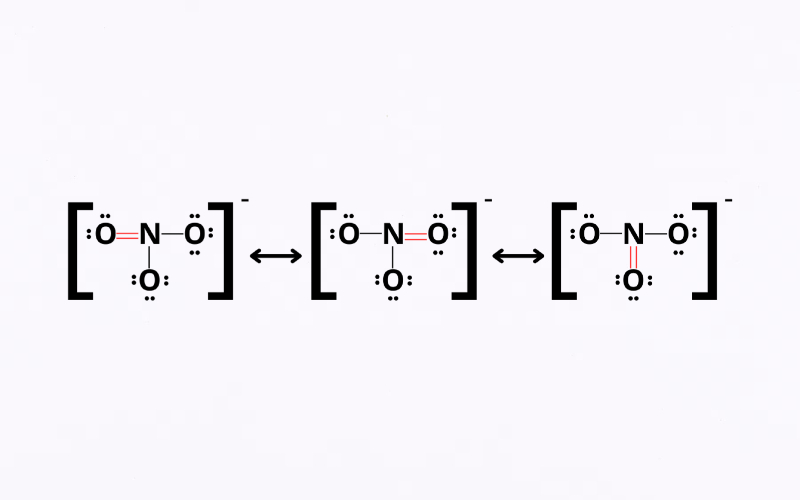
La estructura de Lewis es una representación gráfica utilizada en la química para mostrar cómo se distribuyen los electrones alrededor de los átomos dentro de una molécula. Esta herramienta es esencial para comprender las propiedades químicas y la reactividad de los compuestos.
Contenido
Origen y desarrollo de la estructura de Lewis
El concepto fue propuesto por el químico estadounidense Gilbert N. Lewis en 1916. Su objetivo era proporcionar una manera visual de representar los enlaces químicos y la distribución de electrones en una molécula. Es especialmente útil para entender la química orgánica y inorgánica, y es una parte fundamental de la educación química a nivel secundario y universitario.
Representación de electrones y enlaces
En una estructura de Lewis, los electrones de valencia se representan como puntos alrededor de los símbolos de los elementos. Estos puntos pueden formar pares para representar enlaces covalentes. Existen varias reglas y principios que guían la elaboración de estas estructuras:
Regla del octeto
Uno de los principios fundamentales es la regla del octeto. Esta regla establece que los átomos tienden a formar enlaces de manera que cada átomo tenga ocho electrones en su capa de valencia, emulando la configuración de los gases nobles. Aunque hay excepciones, como el hidrógeno y el helio, que sólo requieren dos electrones, la regla del octeto es un buen punto de partida para la mayoría de las estructuras.
Pares solitarios
Además de los electrones que participan en enlaces, también es importante considerar los pares solitarios. Estos son electrones que no están compartidos entre átomos y permanecen en una sola especie química. Los pares solitarios juegan un papel crucial en la geometría molecular y en las propiedades reactivas de las moléculas.
Enlaces múltiples
Las estructuras de Lewis también permiten representar enlaces dobles y triples. En un enlace doble, dos pares de electrones se comparten entre dos átomos, mientras que en un enlace triple, se comparten tres pares. Estos enlaces múltiples afectan significativamente la longitud del enlace y la energía de enlace.
Aplicaciones
Predicción de geometría molecular
Una de las aplicaciones más importantes de las estructuras de Lewis es la predicción de la geometría molecular. Utilizando el modelo de Repulsión de Pares de Electrones de la Capa de Valencia (RPECV), se puede determinar la disposición espacial de los átomos en una molécula. Esta información es vital para entender las propiedades físicas y químicas de las sustancias.
Reactividad química
Las estructuras de Lewis también son esenciales para predecir la reactividad química. Al visualizar cómo se distribuyen los electrones, los químicos pueden anticipar cómo interactuarán las moléculas durante las reacciones químicas. Esto es particularmente útil en la síntesis de nuevos compuestos y en la catálisis.
Formación de compuestos iónicos
Aunque las estructuras de Lewis se utilizan principalmente para compuestos covalentes, también son útiles para entender la formación de compuestos iónicos. Al mostrar cómo se transfieren los electrones de un átomo a otro, se puede comprender la creación de iones y la atracción electrostática que resulta en la formación de un enlace iónico.
Limitaciones
A pesar de su utilidad, tiene sus limitaciones. No siempre puede representar con precisión la realidad, especialmente en casos de moléculas complejas o iones de transición. Además, no proporciona información sobre la energía de enlace o la longitud de enlace con precisión. En tales casos, es necesario utilizar técnicas más avanzadas, como la teoría del enlace de valencia (TEV) o la teoría de los orbitales moleculares (TOM).
Ejemplos prácticos de estructuras de Lewis
Molécula de agua (H₂O)
Para la molécula de agua, el oxígeno tiene seis electrones de valencia, mientras que cada hidrógeno tiene uno. Al compartir electrones, se forman dos enlaces covalentes, y el oxígeno queda con dos pares solitarios. La estructura de Lewis de H₂O muestra un ángulo de enlace de aproximadamente 104.5 grados, lo que explica su forma angular.
Dióxido de carbono (CO₂)
En el caso del dióxido de carbono, el carbono central tiene cuatro electrones de valencia y cada oxígeno tiene seis. El carbono forma dos enlaces dobles con cada oxígeno, resultando en una estructura lineal. Esta representación ayuda a entender la geometría lineal y la simetría de la molécula de CO₂.
Ión amonio (NH₄⁺)
Para el ión amonio, el nitrógeno tiene cinco electrones de valencia y cada hidrógeno uno. El nitrógeno forma cuatro enlaces covalentes con los átomos de hidrógeno. Debido a la carga positiva, no hay pares solitarios en el nitrógeno, y la estructura de Lewis muestra una geometría tetraédrica.
Importancia educativa
La enseñanza de la estructura de Lewis es un componente crucial en los cursos de química. Proporciona a los estudiantes una base sólida para comprender cómo se forman y comportan las moléculas. Además, fomenta el desarrollo de habilidades analíticas y de resolución de problemas que son fundamentales para el avance en estudios científicos y profesionales.
Contribuciones modernas y avances
Desde la propuesta original de Lewis, ha habido numerosos avances en la forma en que entendemos los enlaces químicos. Las técnicas modernas de espectroscopia y cristalografía de rayos X han permitido a los científicos ver las posiciones exactas de los átomos y electrones en las moléculas. Estas herramientas han complementado y, en algunos casos, superado las limitaciones de la estructura de Lewis, proporcionando una visión más detallada de la química molecular.
Conclusión
La estructura de Lewis sigue siendo una herramienta invaluable en la química moderna. Su capacidad para representar la distribución de electrones y predecir la geometría molecular ha demostrado ser fundamental en la educación y la investigación química. A pesar de sus limitaciones, las estructuras de Lewis proporcionan una base sólida para comprender la reactividad y las propiedades de las moléculas, y continúan siendo una parte esencial del lenguaje químico.