La conjugación de elementos no metales y metales es el inicio de un enlace iónico. Con estructuras gigantes en forma de cubo, se ha convertido en un estudio interesante en los estudiantes. Sobre todo, cuando se relaciona con el uso en la vida diaria y en las industrias que explotan sustancias iónicas.
Contenido
El enlace iónico y su estructura
Un enlace iónico es formado por la transferencia de partículas entre un par de átomos. En este caso, los elementos de los grupos metales y no metales son fuente esencial en esa interacción. Un proceso donde los metales tienden a perder electrones estableciendo una carga positiva, por eso son conocidos como cationes. Ahora, los no metales son lo contrario, estos ganan y mantienen una red negativa, produciendo aniones.
La interacción es originada por numerosas cantidades de iones, una limitación con solo un par de cargas es imposible. Además, la fuerza electroestática con iones de distintas cargas, impulsa la formación de un compuesto solido o líquido. La estructura es plasmada en un modelo tridimensional con una variedad de iones creando un compuesto de gran tamaño. Visualizar la ionización requiere de trazados correctos, enfocando la forma de la celda unitaria.
Clases de celdas unitarias
La celda unitaria solo es una parte del compuesto, la idea es tomar un área repetitiva y mostrar cada interacción. Las demás celdas a su alrededor, vértices y aristas, también son utilizadas en el recorrido de los iones. Con formas cúbicas, las celdas se dividen en tres tipos:
- Simple: es una figura cubica, la cual contiene 8 partículas que se ubican en cada vértice.
- Centrada en el cuerpo: con 8 partículas distribuidas en los vértices, se diferencia de la simple por mantener una más en el núcleo. Esta es distinta a las otras 8, por eso, se identifica como centrada en el cuerpo.
- Centrada en las caras: la misma cantidad de partículas en los vértices establecida en los demás cubos. Sin embargo, en cada cara existe una partícula, formando una red con un total de 14 puntos similares.
Aspectos que destacan en un enlace iónico
La evaluación de un enlace iónico requiere un estudio de los rasgos que más destacan en su composición. A partir de ahí, el concepto es conocido a fondo y se despejan ciertas inquietudes. En la siguiente lista se explican esos aspectos fundamentales:
- Las cargas con la finalidad de formular un compuesto estable con pérdidas y ganancias de cargas, se emplean términos específicos como: catión y anión.
- Los átomos reaccionan en la situación de ionización y traspasan las partículas correspondientes. Los dos elementos proceden a interactuar con ellos, los cuales se posicionan en dirección a orbitar entre los dos átomos.
- Este enlace es débil con la aplicación de fuerzas exteriores, optando por una repulsión suele romper su composición.
- Haciendo uso de un macroscópico, se pude evidenciar un material formado por estructuras cristalinas.
- Es necesario una energía considerable que de origen partículas de catión, también una electricidad que promueva a los aniones.
- Presenta una estabilidad fuerte cuando los iones son de tamaño diminuto, la atracción es favorable.
- Jamás se concretaría un enlace de este tipo, participando partículas con un nivel neutro.
Propiedades (Punto de fusión y ebullición)
El enlace iónico se dispersa en el espacio hasta el alcance de los iones distribuidos, evitando realizar un recorrido específico. De tal manera, los compuestos adquieren una alta solidez por la unión establecida y otras propiedades. La electronegatividad por ejemplo, es una causa principal del enlace, empleando elementos (metales y no metales), esa particularidad es variante. Contar con una diferencia notable es una imposición para conseguir el intercambio de electrones.
- Aprovechando el compuesto –NaCl- como ejemplo, se destaca el nivel correspondiente a los puntos de fusión en estos enlaces. Con una temperatura alrededor de los 801 °C, la sal es derretida, a causa de la ionización. En este sentido, se evidencia el poder de una propiedad referente al punto de fusión en estos compuestos.
- En seguida de culminar la etapa de fusión, el NaCl adquiere un estado líquido, movilizándose con mucha más libertad. Diferentes iones se ubican en la parte superior, en este caso particular, Na+ junto al Cl– , crean una tensión. La electronegatividad que ahí se establece es fuerte, al punto de obstaculizar el paso de iones a un estado gaseoso. Por eso, la temperatura se ubica en 1465 °C, la intención es conseguir una presión como la atmósfera.
Explicación de la composición NaCl
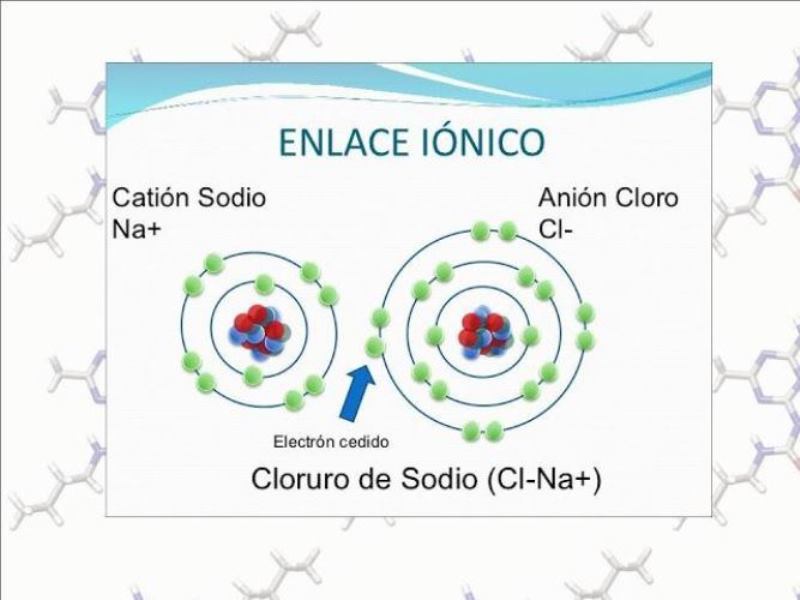
Si bien es cierto, un enlace iónico se formula con aniones y cationes, en busca de neutralizar los dos átomos. El objetivo se plantea con la intención de transferir electrones y protones, creando dos núcleos con la misma electricidad. Tomando un elemento metal de la tabla periódica, se puede interpretar los cambios que se producen. Un ejemplo es el Na (Sodio), de acuerdo a sus 3 capas, distribuye los electrones de la siguiente manera:
- 1.ª Capa: 2 electrones
- 2.ª Capa: 8 electrones
- 3.ª Capa: 1 electrón
Como consecuencia a la poca cantidad de electrones en su última capa, el Na es un elemento fácil de perderlos. Sucede lo contrario con el Cl (cloro), el cual gana electrones por disponer de una última capa repleta. Su estructura se encuentra conformada, así:
- 1.ª Capa: 2 electrones
- 2.ª Capa: 8 electrones
- 3.ª Capa: 7 electrones
Con la transferencia de un electrón por parte del Na a un elemento como el Cl, la composición es estable. Un ion de Na+, con cargas positivas y un catión de Cl- con cargas negativas, fusionan para generar el enlace. Cumpliéndose la regla donde dos átomos con cargas distintas, provocan una atracción.
Ventajas en los sectores industriales
Las industrias emplean sustancias iónicas de forma recurrente, tal es el caso del yoduro de potasio y óxido de hierro. La primera está enfocada en prevenir la enfermedad hipotiroidismo, provocada en el ser humano por insuficiente yodo en el sistema. La segunda, es utilizada en materiales de cerámica para lograr un pigmento de tipo oxido ferroso u oxido férrico. Además, agrega color en el cemento, empleado en la construcción de estructuras como; edificios, casas, puentes, etc.